近年来,蛋白模拟仿生合成凭借其绿色、简洁和易于多功能集成等优点逐渐成为肿瘤诊疗纳米探针制备领域的一个重要分支。目前,已有多种蛋白作为模板仿生合成纳米探针。然而,蛋白仿生合成后的原本蛋白功能或活性是否保持却往往被忽视。有效保持蛋白活性并助力探针在体内肿瘤诊疗应用具有重要意义。
同济大学医学院张兵波课题组长期致力于蛋白仿生分子影像/治疗探针的设计、制备及其在肿瘤诊疗中的应用和相关机理研究。近年来,课题组先后开展了蛋白仿生修饰(Langmuir, 2012, 28, 16605; ACS Nano, 2018, 12, 4246)、蛋白仿生合成与仿生集成(ACS Nano, 2016, 10, 10245; Biomaterials, 2018, 161, 256)、蛋白仿生合成机制及其扩展研究(Bioconjugate Chemistry, 2017, 28, 330)等一系列工作。
近日,该课题组首次利用辣根过氧化物酶(HRP)介导仿生合成超小Gd纳米探针,同时仿生集成底物2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS),最终获得Gd@HRPABTS 诊疗探针。他们发现反应前后HRP的活性得到有效保持,并测试计算得到大约70%酶活性得以保持。随后利用酶活性,将酶仿生合成与酶催化相结合,利用肿瘤组织富含的H2O2触发HRP酶活性,并高效催化ABTS转化成光敏性ABTS•+,后者具有较强的近红外光吸收能力,并能将光能高效转化成热量,实现肿瘤微环境响应的光声成像与光热治疗,并全程利用Gd纳米粒进行MR成像引导。
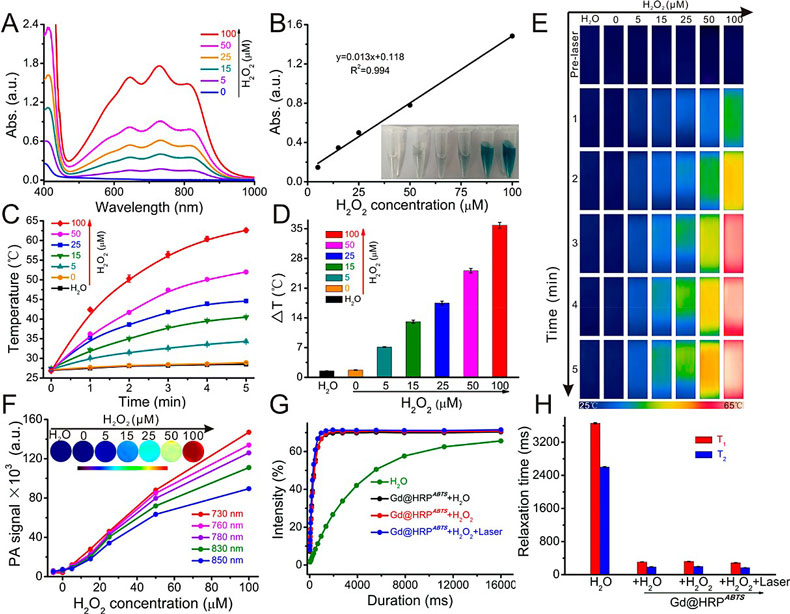
图1:Gd@HRPABTS 探针中HRP酶在H2O2环境中催化ABTS的实验研究
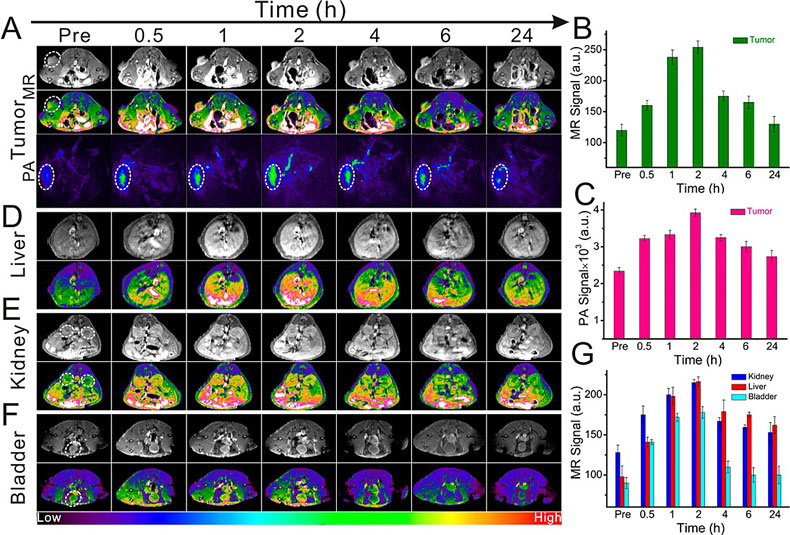
图2:基于酶活性的Gd@HRPABTS 探针在肿瘤微环境中的特异性光声成像及MR成像
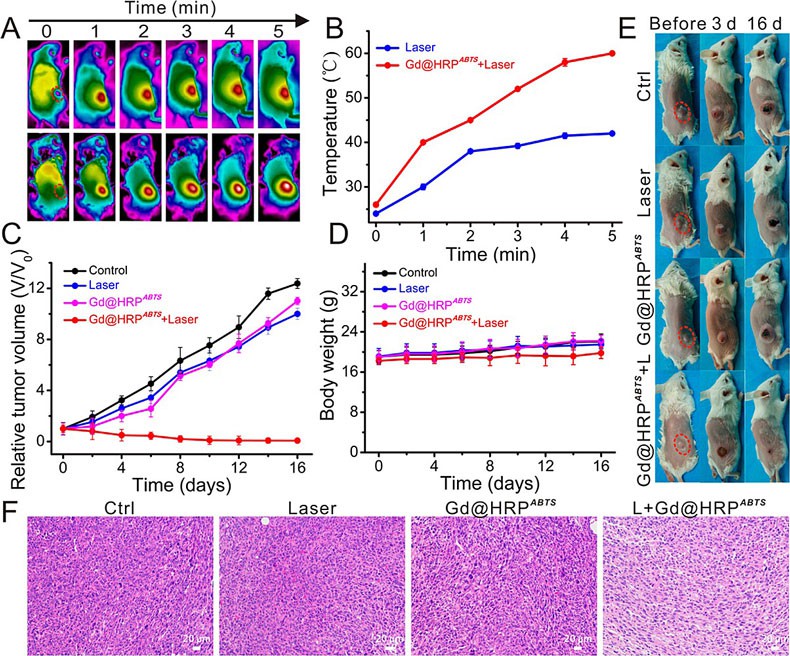
图3:基于酶活性的Gd@HRPABTS 探针体内肿瘤特异性光热治疗研究
此项研究成果发表在ACS Nano(IF:13.709)上,并被评为当期的副封面(Supplementary Cover)。本文第一作者为同济大学医学院博士后杨维涛博士,通讯作者为同济大学医学院的张兵波博士。该工作是在同济大学医学院附属皮肤病医院(筹)光医学研究所以及生物医学工程与纳米科学研究院完成。该工作得到了复旦大学附属公共卫生临床中心施裕新教授和石秀东博士的大力支持。本研究受到国家自然科学面上项目的经费支持。

图4: 本研究工作被评为当期的副封面图(Supplementary Cover)
该论文信息为:Weitao Yang, Xiudong Shi, Yuxin Shi, Defan Yao, Shizhen Chen, Xin Zhou , Bingbo Zhang*, Beyond the Roles in Biomimetic Chemistry: An Insight into the Intrinsic Catalytic Activity of an Enzyme for Tumor-Selective Phototheranostics. ACS Nano, 2018, 12, 12169–12180.
https://pubs.acs.org/doi/10.1021/acsnano.8b05797