5月7日,同济大学医学院贾鑫明教授课题组在Science Advances杂志上发表题为“E3 ligase c-Cbl regulates intestinal inflammation through suppressing fungi-induced noncanonical NF-κB activation”的研究论文。报道了E3泛素连接酶c-Cbl负向调控肠道真菌介导非经典NF-κB活化来抑制肠道炎症的新机制。
肠道真菌对于调节宿主的免疫稳态至关重要,其潜在机制尚不清楚。该研究发现,DCs特异性敲除c-Cbl的小鼠(c-Cblf/fCD11cCre/+)更加易感DSS诱导的结肠炎,且与肠道共生真菌紊乱相关。进一步研究发现,真菌胞壁多糖α-mannan可通过Dectin-2/3-Syk信号通路来调控c-Cbl的磷酸化和功能。因此,c-Cbl敲除显著地降低了α-mannan刺激介导DCs中IL-10的产生;同时,c-Cbl也是真菌胞壁多糖α-mannan发挥肠道免疫保护所必须。机制上,α-mannan刺激促进DCs中c-Cbl和RelB的相互作用,介导RelB的泛素化和降解,进而调控非经典NF-κB激活,最终抑制经典NF-κB成员p65对il-10基因的转录。因此,利用NIK抑制剂抑制非经典NF-κB信号通路可以恢复DCs中α-mannan刺激介导IL-10的产生,以及缓减c-Cblf/fCD11cCre/+小鼠经DSS诱导结肠炎。该研究进一步发现,α-mannan刺激可促进DCs中c-Abl和c-Cbl的相互作用,并介导c-Cbl的磷酸化,进而来调控c-Cbl的功能和RelB的稳定性,进而调控RelB的入核和IL-10的产生。利用c-Abl的激动剂DPH来激活c-Cbl,可以较好的缓减DSS诱导的结肠炎。
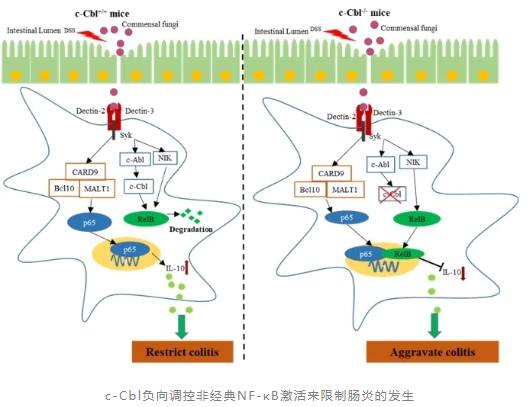
综上所述,该研究发现DC特异性敲除c-Cbl致使小鼠更加易感DSS诱导的结肠炎,且与肠道共生真菌紊乱相关。同时,该研究进一步解析了相应的作用机制,即c-Cbl与RelB的相互作用,介导RelB 泛素化,进而调控真菌多糖α-mannan介导非经典NF-κB通路的活化。最后,该研究还发现,c-Abl可协同α-mannan来激活c-Cbl,最终调控c-Cbl的功能。总之,该研究不仅揭示了c-Cbl在先天免疫细胞中的功能,同时也表明c-Abl-c-Cbl轴可成为开发治疗IBD药物的新靶点。
同济大学医学院博士研究生段杰林为该论文第一作者,同济大学医学院贾鑫明教授为论文的通讯作者。
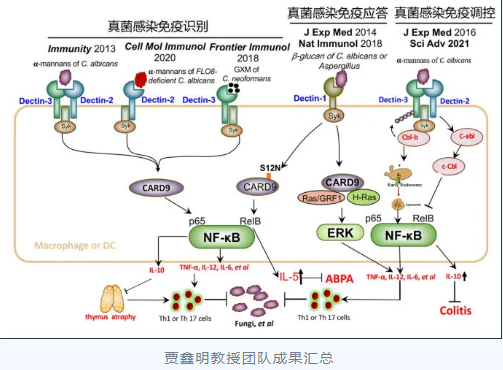
贾鑫明教授率领团队围绕“真菌感染与免疫”(成果汇总见下图),系统研究了C型凝集素受体形成同源或异源二聚体识别真菌的多样性机制,阐明C型凝集素受体下游关键接头蛋白CARD9先天性变异导致真菌病发生的新机制,发现真菌病人先天性免疫缺陷新的免疫检查点,揭示E3泛素链接酶Cbl-b和c-CBL负调控C型凝集素受体介导抗真菌免疫的新机制,奠定以C型凝集素受体通路为靶点研发免疫治疗新策略的理论基础。
上述成果申请人以通讯或共同通讯作者发表在Immunity、Nat Immunol、J Exp Med(2篇)、Sci Adv和Cell Mol Immunol等期刊共20余篇论文,总被他引300余次,单篇最高他引160次。并以第一完成人获得2020年教育部自然科学一等奖。担任上海市免疫学会感染免疫专委会副主任委员、中国菌物学会医学真菌专业委员会委员、中国细胞生物学学会免疫细胞生物学分会理事、上海市免疫学会第十二届理事会理事、《中国真菌学》杂志编委。