DNA损伤修复功能的减弱是细胞,器官和生命个体衰老的主要因素之一。近年的研究提示在众多神经退行性疾病患者的脑组织切片中都发现了损伤DNA的积累。神经细胞(神经元)是终末分化细胞,没有增值能力,是人体内寿命最长的细胞类型(理论上讲,神经元的寿命和我们人的寿命是一样长的),所以DNA损伤修复的能力和基因组稳定性对神经元功能维持尤其重要。2021年7月1日,中国科学院生物与化学交叉研究中心王文元/同济大学徐俊/华山医院王坚团队在Nature Communications上在线发表“Long noncoding RNA BS-DRL1 modulates the DNA damage response and genome stability by interacting with HMGB1 in neurons”的研究文章。该研究首次报道并命名了一个新的大脑特异性非编码核糖核酸(lncRNA)BS-DRL1, 并且揭示了其参与调控神经细胞DNA损伤应答和基因组稳定性的机制。
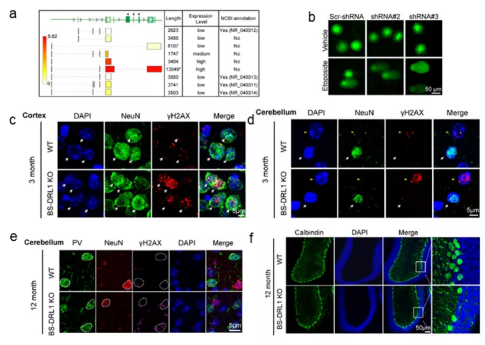
体内体外实验表明,BS-DRL1的缺失会使原代培养的神经细胞,小鼠大脑皮层及小脑中浦肯野细胞在损伤诱导下积累更多的损伤DNA(附图b-d)。且未修复的DNA损伤在生理条件下也会随着小鼠的年龄的增加而积累(附图e),进而造成特定神经细胞随着衰老渐进性死亡(附图f)。
该工作详细阐述了BS-DRL1的作用机制:一方面在DNA损伤应答早期, BS-DRL1和HMGB1以相反的作用机制,相互制约早期响应蛋白的磷酸化水平,使其在一个正常范围内;另一方面,在损伤修复阶段,BS-DRL1作为支架蛋白,招募相关蛋白到损伤位点进行修复,从而维持基因组的稳定性。该研究揭示长链非编码RNA在神经系统中参与调控DNA损伤应答并影响衰老相关表型。
上述工作由中科院上海有机所生物与化学交叉研究中心王文元研究员,同济大学医学院、同济大学附属东方医院徐俊教授和复旦大学附属华山医院王坚教授为共同通讯作者,中科院上海有机所生物与化学交叉研究中心博士生娄敏敏,唐晓强和同济大学医学院、同济大学附属同济医院博士后汪光明为共同第一作者。该研究由国家自然科学基金委,科技部重大专项和上海市高峰人才团队专项资金支持。