近日,同济大学医学院催化医学中心“生物材料与诊疗技术”课题组王祎龙团队在《Advanced Science》期刊上发表了题为“Lactate Efflux Inhibition by Syrosingopine/LOD Co-Loaded Nanozyme for Synergetic Self-Replenishing Catalytic Cancer Therapy and Immune Microenvironment Remodeling”的研究论文,针对肿瘤细胞有氧糖酵解代谢大量乳酸并外排造成的细胞膜内外pH反向梯度,使得在肿瘤细胞和肿瘤免疫抑制微环境两个层面都存在难以实现高效、低毒副作用的协同治疗的难题,报道了基于联合载带临床“老药”Syrosingopine和乳酸氧化酶LOD的纳米酶载体抑制肿瘤细胞的乳酸外排,以“一石三鸟”的策略,实现了原料自补给的增强催化治疗、饥饿治疗和肿瘤免疫抑制微环境逆转的高效协同治疗效果。

研究背景
肿瘤的发生、发展是由一系列系统性改变驱动的,使其能够快速生长、迁移、侵袭、免疫逃避和远端转移。最直观的表现为代谢重编程,通过糖酵解供能并产生大量乳酸,被称为“Warburg效应”。乳酸被持续排出细胞膜外,由此产生的细胞内和细胞外反向pH梯度是癌症生物学的直接表现之一,它诱导了癌细胞持久生存的弱酸性微环境和更容易免疫逃逸的免疫抑制微环境。
肿瘤催化治疗作为一种新兴的肿瘤治疗方式,近年来获得了蓬勃的发展。具有类酶活性的催化治疗纳米载体由于微环境响应性及以病灶部位物质为反应物,具有更加优良的特异性和更低的毒副作用,作为传统肿瘤治疗的补充技术显示出巨大的潜力,使其成为肿瘤治疗领域的一种新兴和极富前景的方法。但是,肿瘤催化治疗领域仍然面临诸多挑战:比如因为肿瘤部位类芬顿反应的原料不足,肿瘤部位的乏氧环境,以及肿瘤细胞的特殊能量代谢途径造成的特定肿瘤微环境。
这其中,弱酸性的微环境(即高浓度乳酸),是肿瘤免疫抑制微环境塑造的重要参与者。具体表现为,高浓度乳酸会直接诱导NK细胞、CD8+T细胞活性下降和凋亡;而免疫抑制的Treg细胞乳酸耐受度高,可以处理和利用乳酸提供能量,产生增殖所需的中间体;乳酸诱导M2型巨噬细胞极化,有利于肿瘤增殖、迁移和血管生成等。
基于细胞内和胞外微环境中乳酸与纳米酶催化反应速率和肿瘤免疫微环境的内在联系,设计构建一种可简单制备的纳米酶催化载体平台,以细胞乳酸外排行为的调控同时显著改善肿瘤细胞内的催化治疗和饥饿治疗效果,并重塑肿瘤免疫微环境是一个新的思路。
研究过程
研究团队以空心四氧化三铁纳米颗粒(HFN)为载体和催化剂,设计并合成了乙酯利血平(Syrosingopine, Syr)和乳酸氧化酶(LOD)双载的Syr/LOD@HFN治疗平台。Syrosingopine 作为一种曾被临床使用的降压药,可以同时阻断MCT1和MCT4乳酸转运的功能,将乳酸滞留在肿瘤细胞内,从而实现逆转肿瘤细胞内外pH梯度。细胞内酸性的增强极大地加速了类芬顿反应速率。LOD将滞留的乳酸,源源不断的转化为H2O2,补充催化反应的原料。而且,胞外微环境乳酸浓度的降低,对多种免疫细胞抑瘤均有积极作用。而且,由于乳酸堆积,糖酵解通路会因为产物浓度升高而被抑制,联合ROS损伤线粒体,实现了肿瘤细胞的有氧代谢和糖酵解的能量供给方式的双重抑制,切断了肿瘤细胞的能量物质ATP的供应。因此,无论是在体内还是体外研究中,该纳米平台均表现出了对小鼠黑色素瘤极高的抑制效率,并且由于免疫激活,显著地增强了免疫检查点抑制剂αPD-L1的抑瘤效果。
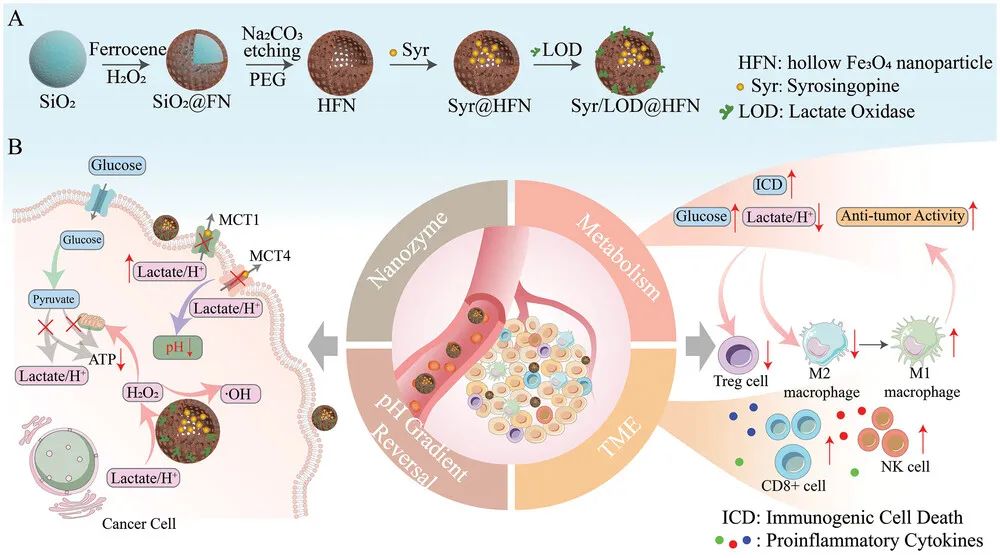
图. 以乳酸外排程度为唯一调节线索实现肿瘤的自增强催化治疗、综合饥饿治疗、以及重塑肿瘤免疫微环境的协同抑瘤作用的载体构建及其生物学效应示意图
研究意义
该纳米平台,一种载体载带两种药物的简单设计具有良好的可靠性,通过药物对细胞乳酸外排的关键单羧酸转运蛋白MCT1/MCT4的功能阻断,有效抑制肿瘤细胞有氧糖酵解产物乳酸的大量外排,实现原料自补给的催化治疗、免疫微环境重塑和通过逆转细胞pH梯度触发的综合饥饿治疗的协同高效抑瘤作用。该纳米平台具有多功能和可扩展性,针对肿瘤的典型生物学特性线索作为多功能治疗载体的单触发器,在胞内和胞外两个方面引发协同的生物学效应;该巧妙设计的纳米系统具有“一石多鸟”的效果,且各抑瘤功能单元几乎不会因为相互干扰造成内部损耗。这个概念在肿瘤细胞模型、裸鼠和带有部分免疫活性的小鼠动物模型上都得到系统性的实验验证,为癌症的协同治疗提供了一个新的思路和研究实例。
本项工作中同济大学2020级博士生吴胜明为第一作者,同济大学王祎龙研究员为论文的独立通讯作者。研究工作得到国家自然科学基金、中央高校基本科研业务费、同济大学附属东方医院等项目资助。
同济大学医学院生物医学工程与纳米科学研究院王祎龙课题组长期致力于磁性纳米材料在肿瘤液体活检与纳米催化治疗用生物材料方面的基础及应用转化研究。本研究成果是在2021年发表于《Advanced Functional Materials》期刊上的题为“GSH-Depleted Nanozymes with Dual-Radicals Enzyme Activities for Tumor Synergic Therapy”的研究进展的延伸和扩展。该研究是针对肿瘤的化学动力学治疗领域最常用的羟基自由基存在半衰期太短而影响抑瘤效果的问题,构建了一种新型的四氧化三铁与施氏矿物的无机纳米复合材料,具有羟基自由基/硫酸根自由基的双自由基生成、GSH耗竭和PTT联合治疗的效果,获得了比较理想的治疗效果。
2023论文连接:https://onlinelibrary.wiley.com/doi/10.1002/advs.202300686
2021论文链接:https://onlinelibrary.wiley.com/doi/abs/10.1002/adfm.202102160
“生物材料与诊疗技术”课题组欢迎具有生物技术、细胞生物学、高分子材料、无机纳米材料、生物医学工程等专业背景的学生加盟!“磁-生”相依,“纳”就一起吧!