癌症作为世界医学难题,一直困扰着人类。针对恶性实体肿瘤,手术切除仍然是目前最为推荐的治疗方式,具有起效快的优点。然而,手术很难将肿瘤组织彻底清除干净,且手术创伤产生的炎症会引发免疫抑制,所以肿瘤切除后若不给予干预措施,术后极易复发和转移。
肿瘤免疫治疗作为近年来新兴的一种治疗方式,备受关注,该疗法是通过免疫治疗剂激活机体自身的免疫系统去杀伤癌细胞。这种治疗方式的优点在于可以治疗癌症中晚期的患者,甚至可以根治一些难治疗的肿瘤,但起效较慢,且无法控制免疫治疗剂的释放量。免疫治疗剂的过度释放将会导致免疫系统的过度激活,产生“细胞因子风暴”和休克体征。针对上述两种治疗方法的优缺点,能否取长补短,开发一种标本兼治的综合疗法?

同济大学附属杨浦医院蔡丰丰副教授联合华东师范大学生命科学学院叶海峰研究员团队利用合成生物学造物致用的思想,巧妙地融合了光遗传学技术、肿瘤手术切除疗法以及肿瘤免疫疗法,开发了一种光控细胞药物工厂,实现远红光可控的、可长期按需调控释放免疫治疗剂的免疫调节工程细胞(FILC)。将该工程细胞包裹于生物相容性极高的水凝胶中,在肿瘤手术切除后植入切除部位,通过远红光光照两小时即可控制表达释放免疫调节细胞因子IFN-β,TNF-α,IL-12,从而调动小鼠自身免疫系统杀伤残余的肿瘤细胞,防止肿瘤复发和转移。
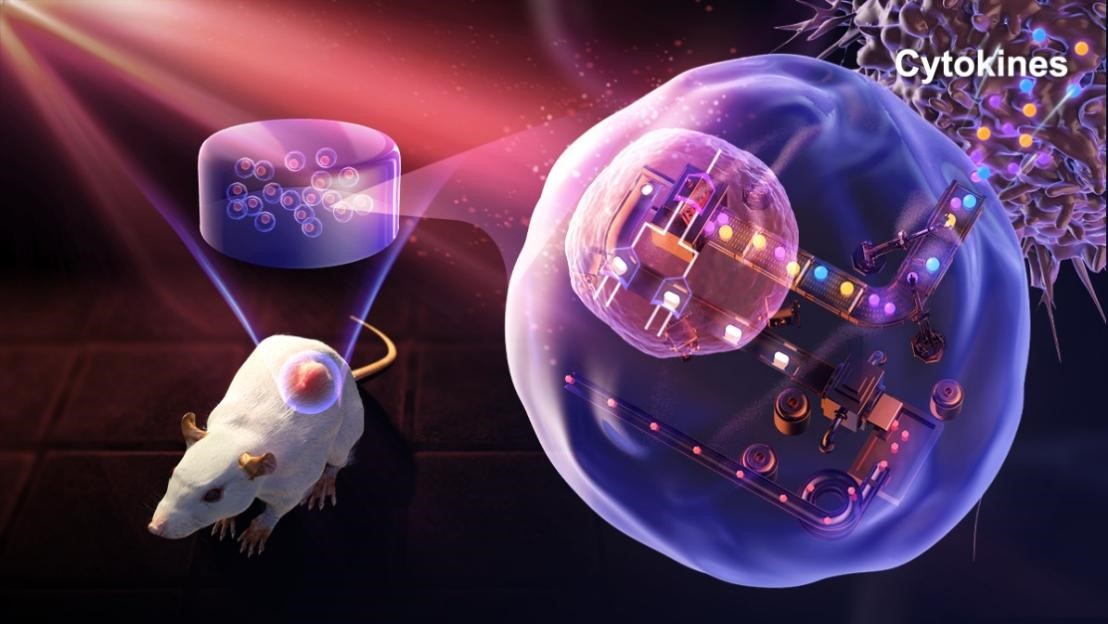
示意图:光控细胞药物工厂可控表达释放细胞免疫调节因子,实现可控肿瘤免疫治疗。
上述研究成果于10月26日发表在Nature Communications期刊上,题为:“Optogenetic-controlled immunotherapeutic designer cells for post-surgical cancer immunotherapy”,该研究开发的远红光调控的新型肿瘤免疫疗法既可以解决肿瘤手术切除疗法易复发和转移的问题,也可以避免肿瘤免疫疗法起效慢以及不可控性产生的非特异性过度激活问题,显著地提高肿瘤手术切除治愈率。该疗法开启了免疫抗癌新思路,同时也扩展了光遗传学技术在生物医学领域的应用,具有潜在的临床转化意义。
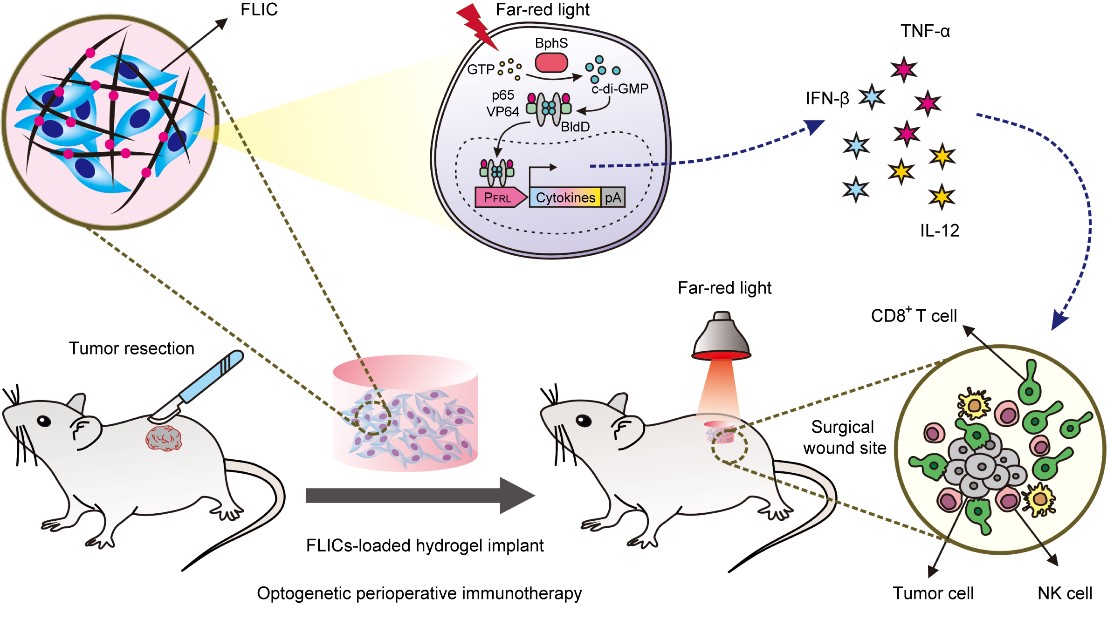
光遗传学技术因其具有非侵入性、可逆性、时空特异性等优点被广泛应用于生物医学研究领域,为疾病治疗提供了新思路和新理念。光作为一种理想的基因表达诱导物,以前所未有的时空精度操控基因表达和细胞行为。随着光遗传学技术的深入研究,使得基于光遗传学的个性化精准治疗和临床转化成为可能。
该项研究通过发现临床问题视角为切入点,基于医学合成生物学的理念,巧妙的融合肿瘤免疫疗法解决实体瘤术后复发的问题。
论文链接:https://www.nature.com/articles/s41467-022-33891-9