动物在面临潜在威胁时,通常会展现出警觉行为。在警觉行为状态下,为了能够对捕食者或危险做出快速反应,动物会降低运动速度甚至保持静止,对周围环境变化保持高度警惕和持续关注,同时提高对厌恶刺激的敏感度,这对于动物的生存和种群延续至关重要。由于缺乏合适的动物模型和行为范式,产生和维持大脑警觉状态的神经机制尚未被揭示。
3月22日,同济大学医学院宋建人教授团队在《自然·通讯》(Nature Communications)杂志上发表了题为“Serotonergic modulation of vigilance states in zebrafish and mice”的研究成果。该研究解析了中缝核5-HT神经元以非传统的激活方式在神经环路水平塑造斑马鱼和小鼠大脑警觉状态的内在机制,有助于理解行为状态产生所必需的神经调质和神经环路之间的相互作用。

研究人员首先发现,给予斑马鱼同类皮肤组织提取物制备的警报物质(Conspecific alarm substance,CAS)刺激,可以有效地诱发斑马鱼产生和维持警觉行为。与对照组相比,处于警觉行为状态的斑马鱼对所有伤害性刺激的逃跑反应阈值降低,即可反映其处于高度的警觉状态(图1)。
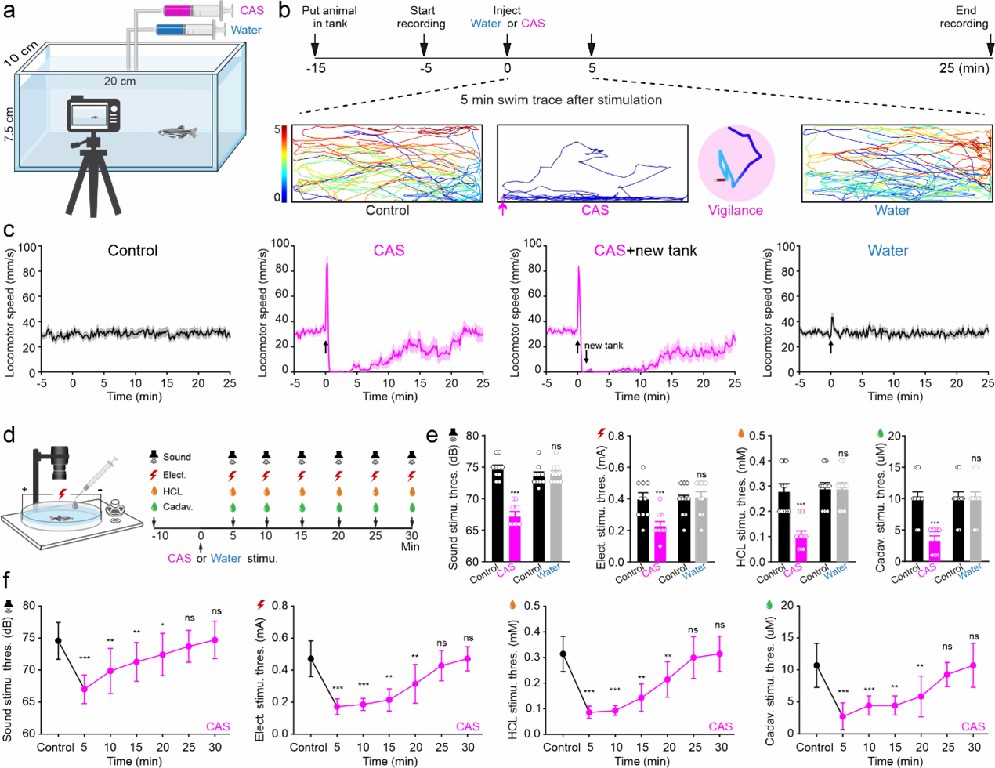
图1 CAS能可靠地诱导斑马鱼产生持续的警觉行为,并增加其对厌恶刺激的敏感性
进一步的研究表明,大脑警觉状态的神经表征为背侧皮层中心区(Central zone of dorsal pallium,Dc,与哺乳动物皮层同源)神经元持续性低频高振幅的同步化活动(图2)。警觉状态下,大脑神经元电活动的同步化依赖于中缝核5-HT神经元强烈且持续的激活。光遗传学激活中缝核5-HT神经元,可诱发Dc神经元电活动同步化。反之,化学遗传学消除中缝核5-HT神经元可阻断CAS诱发的Dc神经元电活动同步化以及警觉行为的发生。
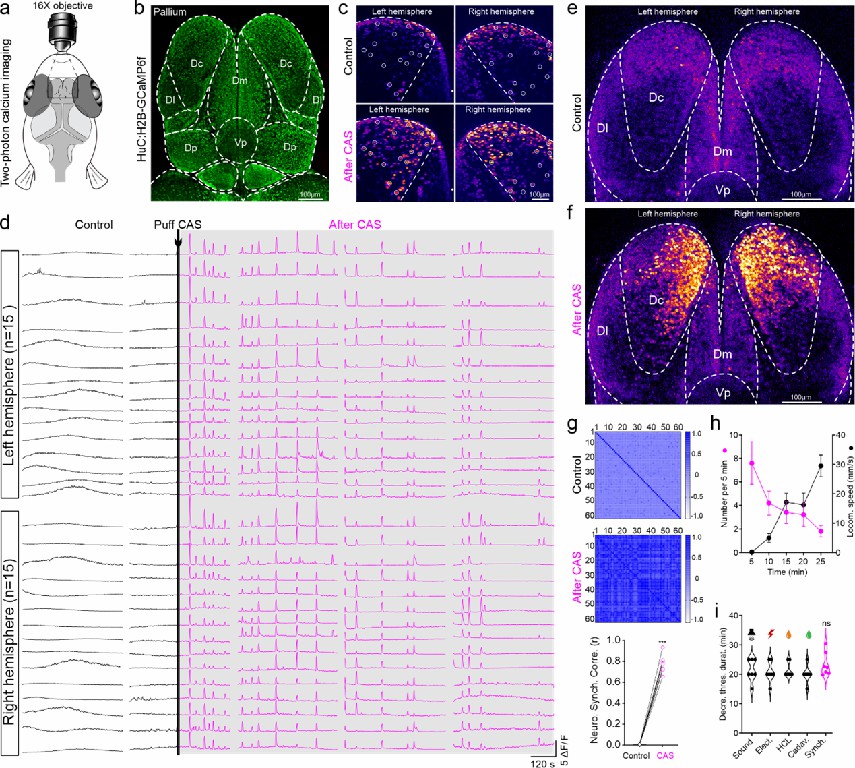
图2 CAS诱导警觉状态的神经表征是斑马鱼Dc区神经元的低频高振幅同步活动
此外,研究人员使用光遗传或化学遗传操纵手段对小鼠中缝核5-HT神经元进行持续激活,小鼠表现出和斑马鱼一样的警觉行为:运动静止并对厌恶性刺激反应的阈值下降。警觉状态下,小鼠脑电表现为低频高振幅的活动,同时前额叶皮层中的兴奋性神经元呈现出簇发性同步放电,伴随瞳孔持续扩大,这一表现与警觉状态高度相关(图3)。通过光遗传激活位于前额叶皮层中的5-HT神经元轴突末梢也同样可以诱发小鼠产生警觉状态。
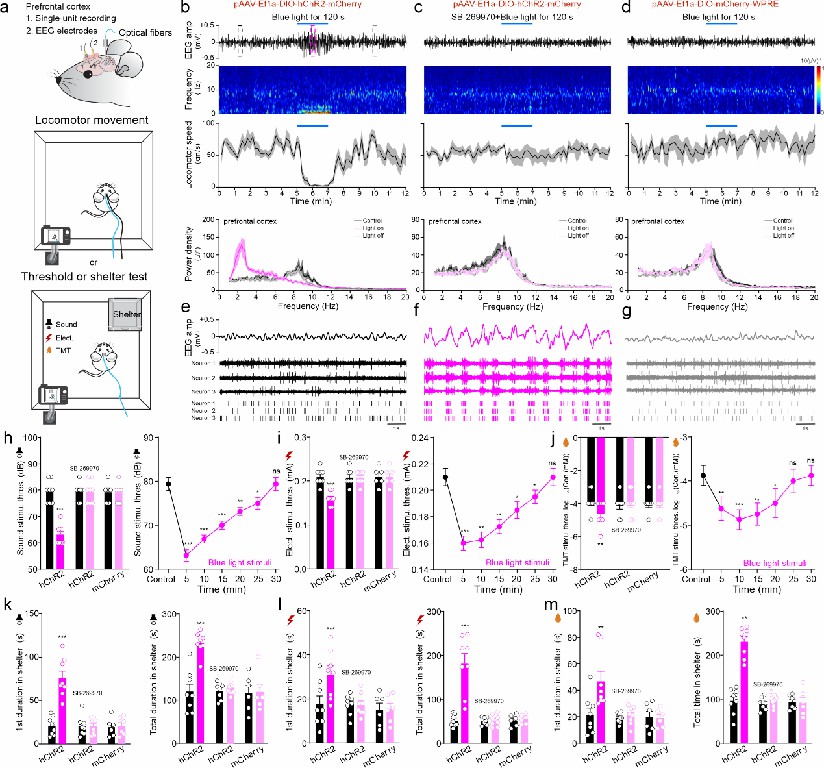
图3 持续光遗传激活DRN 5-HT神经元诱导小鼠大脑同步状态和警觉行为
最后,研究人员采用双光子功能成像结合电生理记录、单细胞RNA-Seq以及基因敲除等技术,进一步解析了5-HT持续激活介导警觉状态产生和维持背后的机制,是5-HT大量释放作用于斑马鱼Dc区域或小鼠前额叶皮层内表达5-HT7受体的兴奋性神经元,导致同步化活动和警觉行为发生。
该研究首次解析了中缝核5-HT神经元以非传统的激活方式在神经环路水平塑造斑马鱼和小鼠大脑警觉状态的内在机制,有助于理解行为状态产生所必需的神经调质和神经环路之间的相互作用。

同济大学医学院宋建人教授和关娜副教授为论文共同通讯作者,同济大学医学院赵杨博士和黄春筱助理教授为共同第一作者。该研究得到国家重点研发计划、国家自然科学基金、上海市科委重大专项、上海市自然科学基金、同济大学附属上海市第四人民医院、同济大学脑与脊髓临床研究中心、同济大学医学院脑功能与人工智能转化研究所等资助。
论文链接:https://doi.org/10.1038/s41467-024-47021-0