前列腺癌是目前全世界男性第二大癌症相关致死性疾病。近年来我国前列腺癌的发病率呈显著增长趋势,严重威胁老年男性生命健康。前列腺癌中TMPRSS2-ERG 基因融合现象十分常见,其在欧美人群中发生率高达50%,在亚洲人群中也占据约四分之一。TMPRSS2-ERG 基因融合导致 ERG 致癌蛋白异常高表达,ERG 致癌蛋白作为恶性促癌转录因子进一步激活下游一系列致癌基因及其表达的致癌蛋白,从而促进前列腺癌发生、发展、侵袭、转移。因此靶向 ERG 致癌蛋白对前列腺癌治疗至关重要,然而迄今仍未见切实有效的治疗方法。
2020年9月17日,国际学术权威刊物 Cell 出版集团旗下子刊、国际顶级分子生物学期刊《Molecular Cell》(IF=15.584)发表了同济大学附属同济医院泌尿外科吴登龙教授课题组与美国梅奥医学中心(Mayo Clinic)黄浩杰教授研究团队合作开展的关于前列腺癌精准医学方面的研究论文,该论文正是通过靶向ERG致癌蛋白遏制前列腺癌进展。
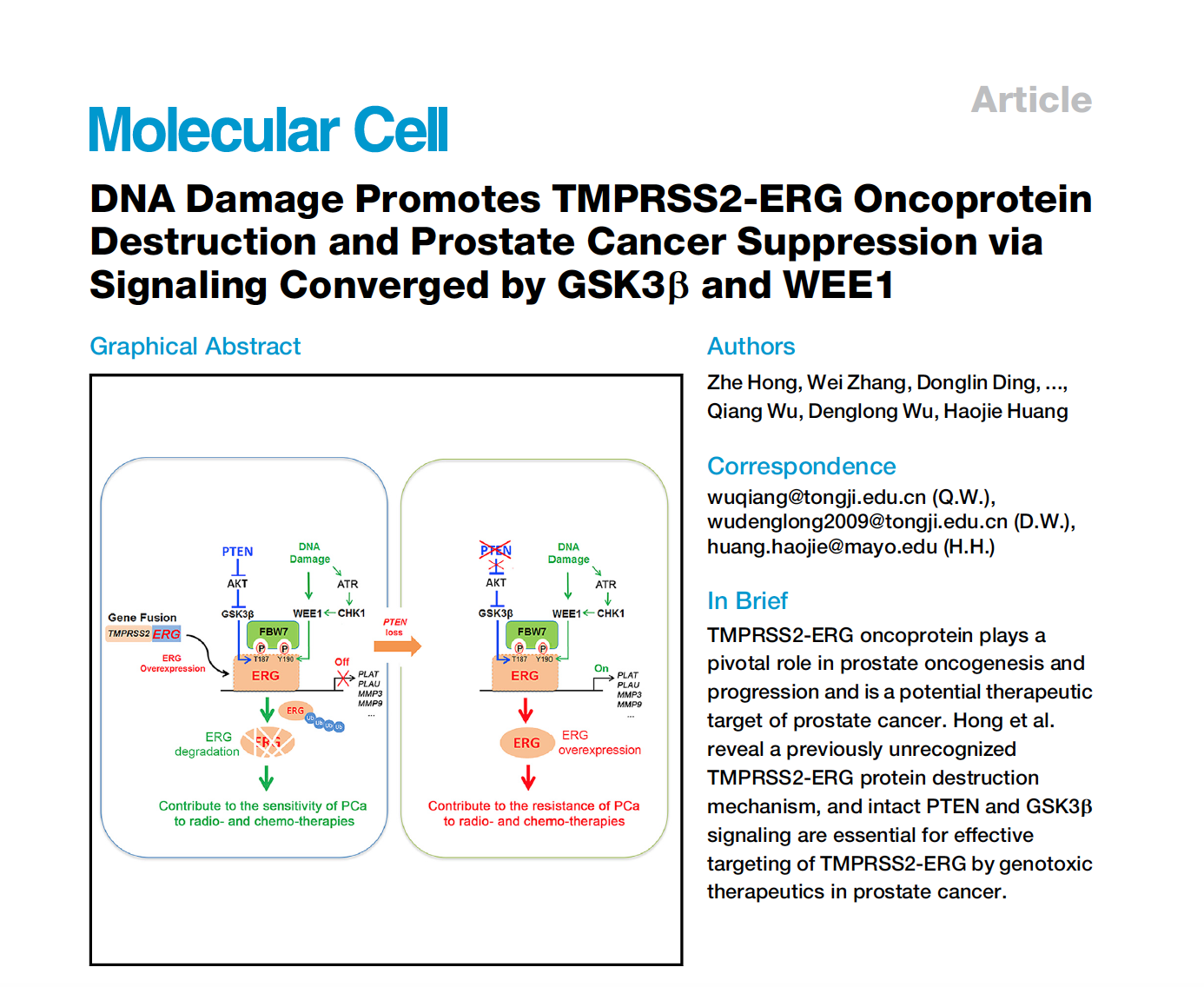
针对 ERG 致癌蛋白,该研究首次发现 DNA 损伤疗法(放射治疗与化学治疗)可以破坏前列腺癌中 ERG 致癌蛋白稳定性,并且该破坏作用与著名抑癌基因 PTEN 功能相关。在 PTEN 功能完整时,DNA 损伤作为激活开关,通过激活 DNA 损伤应答通路下游 WEE1 激酶与 GSK3β 激酶一同开启对 ERG 致癌蛋白的磷酸化过程,从而诱发 ERG 致癌蛋白降解。在 PTEN 功能缺失而导致 GSK3β 失活时,通过联合使用 GSK3β 上游激酶 AKT 抑制剂与 DNA 损伤疗法可以逆转 ERG 致癌蛋白的降解抵抗现象,从而恢复高表达 ERG 致癌蛋白的前列腺癌细胞对 DNA 损伤疗法的敏感性。该研究同时还发现,ERG 致癌蛋白的降解失调是造成前列腺癌对放化疗抵抗及不敏感的重要原因之一。
该项研究针对前列腺癌中最大的亚群 TMPRSS2-ERG 基因融合阳性前列腺癌,深入揭示了 DNA 损伤疗法与 PTEN 功能状况对 ERG 致癌蛋白降解的分子机制,有望为发展靶向 ERG 致癌蛋白治疗前列腺癌提供精准化策略。
从临床中遇到的实际问题出发,针对治疗的难点热点,探索开发新的治疗方法及策略,为瓶颈期癌症治疗打开新的大门是该研究团队的宗旨。该研究成果完美地演绎了从临床出发,到基础理论研究,再回到临床治疗的完整闭环研究路径。
该研究论文第一作者为同济大学附属同济医院泌尿外科住培医师洪哲博士,通讯作者为美国梅奥医学中心黄浩杰教授、同济大学附属同济医院泌尿外科吴登龙教授、吴强医师。

该论文原文链接:https://pubmed.ncbi.nlm.nih.gov/32871104/