2月14日,同济大学附属东方医院刘中民教授/胡益辉副研究员/乐文俊副研究员和大连理工大学孙文教授合作,在Advanced Functional Materials 杂志上发表了题为《Antioxidant Nanozyme-Engineered Mesenchymal Stem Cells for In Vivo MRI Tracking and Synergistic Therapy of Myocardial Infarction》的论文。该论文中,作者合成了兼具成像特性和ROS清除活性的多功能纳米酶,通过细胞内吞作用,构建了工程化干细胞,以实现干细胞的体内跟踪和心梗协同增效治疗。

干细胞优良的旁分泌作用、免疫调节功能、抗炎性能虽然在心肌梗死(简称心梗)治疗中已初见成效,但仍然存在两个亟需解决的挑战:一是心梗部高活性氧(ROS)、高氧化应激、炎症等极端的微环境,导致干细胞的存活率和驻留率低而疗效有限;二是干细胞的体内分布、迁移和归巢不明确,阻碍其临床推广应用。
纳米酶是一类具有类酶催化活性的功能纳米材料,兼具催化和纳米材料的双重功能,已广泛应用于生物传感、免疫分析、成像、疾病诊疗等领域。其中,高效清除ROS的抗氧化纳米酶,已在细胞保护、抗衰老、炎症、缺血性疾病、神经退行性疾病的治疗中有着举足轻重的地位。此外,纳米酶优良的光、热、磁、声等特性,赋予其成像功能,可作为成像造影剂。因此,结合纳米酶的催化活性和成像功能,构建抗氧化纳米酶工程化干细胞,用于干细胞移植后的体内成像示踪和清除ROS改善微环境协同治疗心梗,具有重要的研究价值。

图1 Mn3O4@PDA-MSCs的构建及其在体内的MRI示踪和改善微环境增强心梗治疗。
作者通过聚合反应在Mn3O4纳米酶的表面修饰了聚多巴胺(PDA)涂层,即为Mn3O4@PDA。PDA的修饰具有三个优点:一是提高Mn3O4的生物相容性;二是增强SOD类酶催化活性;三是提升T1加权MRI示踪性能。在此基础上,Mn3O4@PDA通过简单温和的内吞作用进入人脐带间充质干细胞(MSCs)的胞质内,形成Mn3O4@PDA-MSCs,即工程化干细胞(简称E-MSCs)。
体外研究发现与MSCs相比,E-MSCs的干性、分化、迁移、抗氧化和抗炎等性能显著增强。体内示踪实验表明移植24小时内E-MSCs在心梗部位的MIR信号明显增强,治疗结果表明E-MSCs同时发挥了纳米酶的抗氧化和抗炎作用以及MSCs的再生和血管生成功能,从而降低心梗小鼠的心肌纤维化,增强心功能。
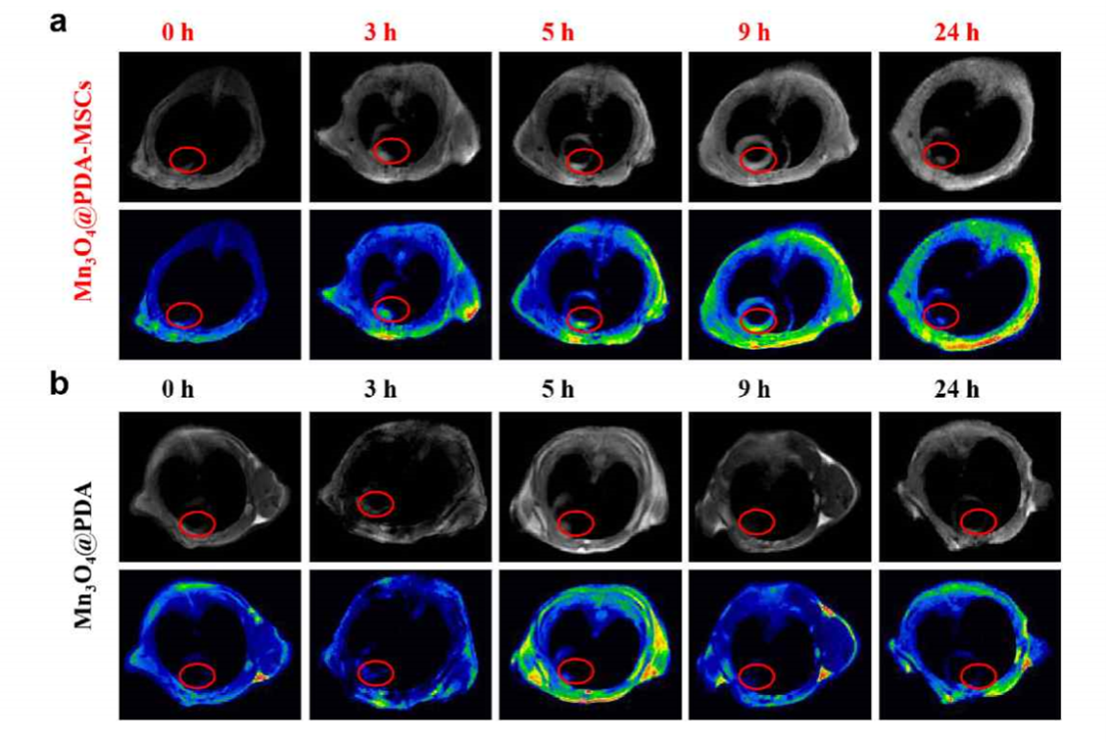
图2 Mn3O4@PDA-MSCs及Mn3O4@PDA在体内的MRI成像。
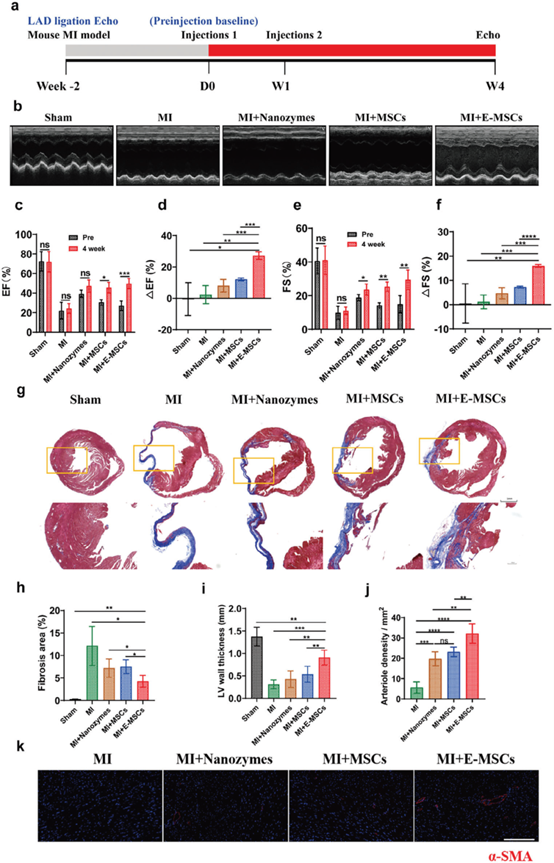
图3 Mn3O4@PDA-MSCs、MSCs、Mn3O4@PDA的体内心梗治疗。
该论文首次报道了抗氧化纳米酶工程化干细胞用于心梗部位示踪和协调治疗。一方面,纳米酶的T1加权特性,可实现干细胞的体内MRI示踪;另一方面,纳米酶可改善心梗微环境(清除ROS、缓解氧化应激、降低炎症),提升干细胞的活性,增强心梗治疗。论文中详细研究了抗氧化纳米酶的MRI示踪和抗氧化、抗炎、迁移等性能,论述了E-MSCs的抗炎和促血管生成作用,并应用于具有临床研究意义的心梗治疗研究。本工作为实现干细胞的体内示踪和增强治疗提供了新材料、新策略。
同济大学医学院、附属东方医院为该研究的第一通讯单位。同济大学医学院、附属东方医院刘中民教授、胡益辉副研究员和大连理工大学孙文教授为论文的共同通讯作者。同济大学附属东方医院副研究员乐文俊、硕士研究生孙泽艺和心外科副主任医师李铁岩为本研究的共同第一作者。另外感谢同济大学附属东方医院再生所马腾副研究员、心衰所刘杰研究员、刘洋副研究员的帮助。此外,该研究受到国家自然科学基金项目、干细胞与转化IV类高峰学科项目及同济大学自主原创基础应用研究项目等经费支持。
原文链接:https://doi.org/10.1002/adfm.202314328