在肿瘤细胞代谢中所产生的大量乳酸,成为肿瘤细胞的“帮凶”,帮助肿瘤细胞躲避化疗药物的杀伤,从而导致化疗耐药。

北京时间今天(12月21日)零点,同济大学医学院/附属东方医院袁健教授课题组在国际顶级学术期刊《细胞》(Cell)上发表了这一重要研究成果,论文题为“Metabolic Regulation of Homologous Recombination Repair by MRE11 Lactylation”(MRE11乳酸化修饰介导代谢调控同源重组修复 )。
这一重要发现为肿瘤代谢与DNA损伤修复之间的联系提供了新的理论依据,也为克服肿瘤耐药提供了潜在的靶点和策略。
研究团队发现,乳酸通过诱导DNA损伤修复关键蛋白——减数分裂重组蛋白11(MRE11)发生乳酸化修饰,促进同源重组修复(HR),导致化疗耐药的分子机制和生物学作用。
肿瘤耐药是导致肿瘤治疗失败的主要因素之一,解决肿瘤的耐药性是提高肿瘤治疗效果的关键。为解析肿瘤的耐药性的分子机制,研究团队首先通过分析癌症基因组图谱数据库,发现了催化乳酸产生的关键代谢酶——乳酸脱氢酶A低表达与HR下调显著相关,暗示乳酸或者乳酸化修饰可能参与了HR的调控。进一步研究发现,提高细胞的乳酸化水平,可以促进HR修复,导致肿瘤细胞对化疗药物耐受。
在分子机制方面,团队发现,MRE11(一种核酸酶,对起始DNA末端切割和同源重组修复具有重要的调控作用)能在乙酰转移酶CBP的催化下发生很强的乳酸化修饰。通过筛选和质谱分析,证实K673是MRE11发生乳酸化修饰的位点。此外研究还发现,高水平的MRE11 K673乳酸化修饰促进了MRE11与DNA的结合,从而促进了DNA末端切割和同源重组修复导致化疗耐药。使用特异性的小分子多肽靶向抑制MRE11 K673乳酸化修饰,能够显著增强铂类或PARP抑制剂化疗药物对肿瘤的杀伤效果。这些结果表明,抑制MRE11 K673乳酸化修饰是一种潜在的提高化疗效果的策略。
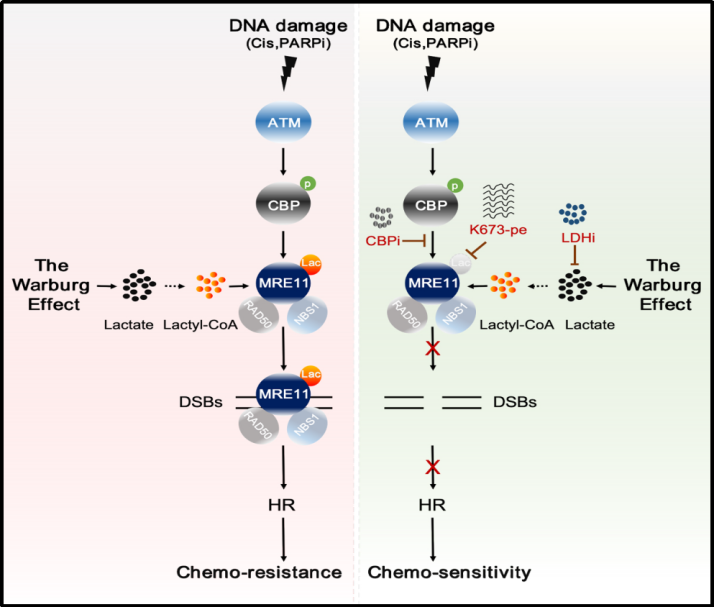
总的来说,该研究揭示MRE11蛋白乳酸化修饰在代谢介导肿瘤耐药中的关键作用,并且为靶向DNA修复联合化疗治疗肿瘤提供了新的理论基础和潜在靶点。
同济大学为论文的第一完成单位,袁健教授为论文的唯一通讯作者,同济大学医学院副教授陈玉平和博士后吴锦欢为本文的第一作者。本课题组与中国科学院上海药物研究所谭敏佳教授课题组、中国医学科学院-北京协和医学院医药生物技术研究所李珂教授课题组、北京大学王嘉东/王维斌教授课题组、深圳大学朱卫国教授课题组和许兴智教授课题组展开了良好的合作。本项研究获得了国家自然科学基金委杰出青年项目、重大项目以及科技部国家重点研发等项目的资助。
袁健教授课题组一直致力于DNA损伤与肿瘤领域的研究,不断探索肿瘤代谢异常与DNA损伤修复、肿瘤发生发展之间的相关性,并深入研究新的DNA修复蛋白及其分子机制和生物功能。近年来,该团队在Cell、Nature Cell Biology、Nature Cancer、Molecular Cell、Science Advances等国际知名期刊上发表了多篇关于DNA损伤应答失衡介导肿瘤发生发展的重要研究成果。
原文链接:https://www.cell.com/cell/fulltext/S0092-8674(23)01276-X